15.9 INSEMINACIÓN ARTIFICIAL
Las hembras que se quieren incluir en los programas de inseminación deben presentar una excelente salud y estatus sanitario, además de poseer la condición corporal requerida para el apareamiento (3-3.5/5). Las hembras mal nutridas y famélicas, a menudo, no ovulan o presentan altos índices de mortalidad embrionaria (hembras más fuertes presentan índices de ovulación más altos). Contrariamente, hembras con sobre acondicionamiento (engrasamiento) tienen dificultades para quedar preñadas, presentando fallas en la concepción y mortalidad embrionaria.
Se debe evitar cualquier tipo de estrés (vacunas, desparasitación, esquila) 6 semanas antes y 4 semanas después de la inseminación.
15.9.1 DETECCIÓN DEL ESTRO PARA LA INSEMINACIÓN
Para detectar el estro es necesario tener presente la duración del ciclo estral, que en ovejas es de 17 días en promedio. Además, debemos considerar que las ovejas en estro no muestran los signos claramente, con lo que se hace necesario emplear machos celadores. Para asegurar la detección de todas las hembras en calor es preciso utilizar al menos 2% de machos celadores, representativo de la cantidad de hembras naturalmente cíclicas. Las hembras que muestran estro deben ser identificadas y apartadas del resto del rebaño.
15.9.2 PREPARACIÓN DE MACHOS CELADORES
Los machos que se utilizan para detectar las hembras que están en celo también se pueden utilizar para estimular el estro y la ovulación en algunas hembras (efecto macho).
Los celadores pueden ser preparados utilizando un mandil de tela, se puede colocar por debajo de la cavidad abdominal del macho (figura 24).
El uso de este método tiene dos inconvenientes. Primero, existe la posibilidad de presentarse montas fértiles cuando el mandil no está bien sujeto; y segundo, puede ocurrir inflamación, irritación o infección en el pene y/o en la zona prepucial, lo que se traduce en una falta de deseo sexual y de comportamiento de monta.
Los machos celadores también pueden prepararse por métodos quirúrgicos: vasectomía, epididimectomía, desviación de pene u orquiectomía. Las dos primeras interrumpen el paso de los espermatozoides desde los testículos a la uretra (pene). Por otro lado, la desviación de pene evita la intromisión del mismo en la vagina de la hembra, mientras que la orquiectomía implica la remoción de los testículos, con lo cual, los carneros carecen de la fuente principal de testosterona, por lo tanto se induce la actividad sexual utilizando implantes o inyecciones de testosterona o uno de sus derivados, induciendo así el comportamiento sexual de los machos. Los machos se pueden emplear desde el año de edad, el tratamiento consiste en la aplicación de tres dosis por vía subcutánea de 150 mg de propionato de testosterona a intervalos de una semana.
15.9.3 TÉCNICAS DE INSEMINACIÓN ARTIFICIAL
Existen tres métodos de inseminación disponibles para utilizar en ovinos dependiendo del sitio de deposición del semen durante el proceso de inseminación.
Inseminación vaginal: es un tipo de inseminación que se realiza a “ciegas”, introduciendo la pistola de inseminación dentro de la vagina (figura 25). Tiene el inconveniente de que no se conoce exactamente donde se deposita el semen. Es un tipo de inseminación exitosa, cuando se utiliza semen fresco. La dosis de inseminación debe ser alta (entre 250 y 500 millones de espermatozoides por dosis).
Inseminación cervical: es la más popular y consiste en introducir un vaginoscopio en la vagina para poder observar la entrada del cérvix y así poder introducir la pistola de inseminación lo más profundo que se pueda. El semen debe ser depositado en el primer anillo cervical. La dosis de espermatozoides a utilizar es de 150 a 300 millones, en un volumen no mayor de 0.5 ml. Es muy adecuada cuando se emplea semen fresco, diluido o congelado, variando en cada caso la cantidad de espermatozoides requeridos en la dosis (figura 26).
Inseminación intrauterina: presenta como inconveniente el costo de los materiales que se requieren para poder llevarla a cabo. Esta inseminación consiste en colocar a la hembra sobre una camilla bien sujeta y realizar dos perforaciones en la pared abdominal por las que se introducen dos trócares, por dentro de los cuales, en una de las vías va un cable de luz fría y un visor que permite observar el interior del abdomen, y por la otra vía se inserta la pistola de inseminación, que debe perforar y penetrar el tejido del útero para descargar el semen directamente en la luz uterina. Esta es la única técnica que permite usar con un alto grado de confiabilidad semen congelado (que se encuentra a -196° C). La cantidad de espermatozoides recomendados para una inseminación exitosa es de aproximadamente 50 millones en 0.25 ml (figura 27).
Este tipo de inseminación también es posible realizar por medio de laparotomía, la cual consiste en realizar una incisión abdominal, exteriorizar el útero y depositar el semen. Es una verdadera operación quirúrgica, que resulta poco implementada por los costos y controles postoperatorios que implica.
15.9.4 COLECTA DE LA MUESTRA SEMINAL
Vagina artificial
La vagina artificial es un método sencillo y rápido, no estresa al macho y resulta en la recolección de semen de mejor calidad.
Proporciona un estímulo térmico (temperatura) y mecánico (presión). La vagina debe tener como dimensiones 15 x 5.5 cm y la temperatura interna debe ser de 42– 45 ºC, la cual es proporcionada por agua (figura 28). Se debe tener cuidado de no dejar el agua muy caliente dentro de la vagina, ya que si el macho la penetra, se quemará, y será muy difícil que a este se le pueda hacer una nueva colecta, ya que el animal puede quedar traumatizado.
La frecuencia con la que se puede colectar el semen utilizando vagina artificial puede ser 2 a 3 veces por día, en días alternos.
Electroeyaculador
El electroeyaculador consta de una batería con un voltímetro y de un electrodo que se introduce vía rectal (figura 29). Al aplicar electricidad, el electrodo estimula la mucosa intestinal y por su cercanía también estimula las glándulas sexuales accesorias y el plexo nervioso pélvico. El impulso eléctrico debe hacerse con una intensidad gradual ascendente y constante, hasta que el estímulo del plexo nervioso provoque una contracción de las glándulas sexuales accesorias y del parénquima testicular, produciéndose así la eyaculación completa. El semen colectado con este método tiene la característica de presentar mayor volumen pero menor concentración.
15.9.5 EVALUACIÓN DE LA MUESTRA SEMINAL
Luego de la colecta del semen, este se debe mantener protegido de la luz directa y de la temperatura, la cual debe mantenerse en 37ºC. Para este fin el semen debe colocarse en baño maría mientras se hace la evaluación de su calidad. Dicha evaluación se debe hacer de una forma rápida, ya que el semen desde el momento de la colecta se empieza a deteriorar con facilidad, afectando de esta forma su fertilidad.
La primera evaluación del semen, inmediatamente después de la extracción, corresponde a la valoración macroscópica, donde se determinan cuidadosamente el volumen, color, olor, viscosidad y densidad.
El volumen seminal en los ovinos se encuentra influenciado por aspectos ambientales, variaciones por animal, raza, edad, número de eyaculados y forma de recolección. Cuando el semen es recolectado por medio de vagina artificial se obtienen generalmente entre 0.5-1.5 ml y cuando se colecta utilizando electroeyaculador el promedio está en 2.5 ml. El semen normal de carnero presenta un color blanco o crema pálido y la densidad del semen varía desde un semen acuoso, lechoso, lechoso-cremoso, hasta un cremoso, estando directamente relacionada con la concentración. Con respecto al olor lo único que se valora es que no sea desagradable.
Después de la valoración macroscópica, se deben evaluar las características microscópicas que incluyen la concentración, motilidad, morfología, integridad de membrana y tolerancia osmótica.
Concentración espermática
La determinación de la concentración espermática es una de las valoraciones rutinarias de contrastación seminal más importantes, ya que la tasa de dilución depende de ella y por ende el número de dosis por eyaculado. La concentración espermática en ovinos es de 2000-6000 x 106/ml.
Existen varias formas para realizar este cálculo, siendo las más utilizadas las cámaras de recuento celular (Neubauer, Burker, Thoma y Makler) y en menor medida se utilizan los contadores celulares electrónicos y los programas informáticos de análisis seminal (figura 30).

Motilidad espermática
Su determinación nos puede proporcionar un medio relativamente sencillo para conocer la calidad seminal. A pesar de que presenta una pobre correlación con la fertilidad in vivo es el parámetro más utilizado junto con la concentración espermática.
Motilidad masal
Esta observación se hace colocando una gota de semen en un portaobjeto precalentado a 37 °C para que los espermatozoides no mueran por un choque térmico, y se observa en el microscopio bajo el lente de 4 ó 10X sin necesidad de colocar el cubreobjeto.
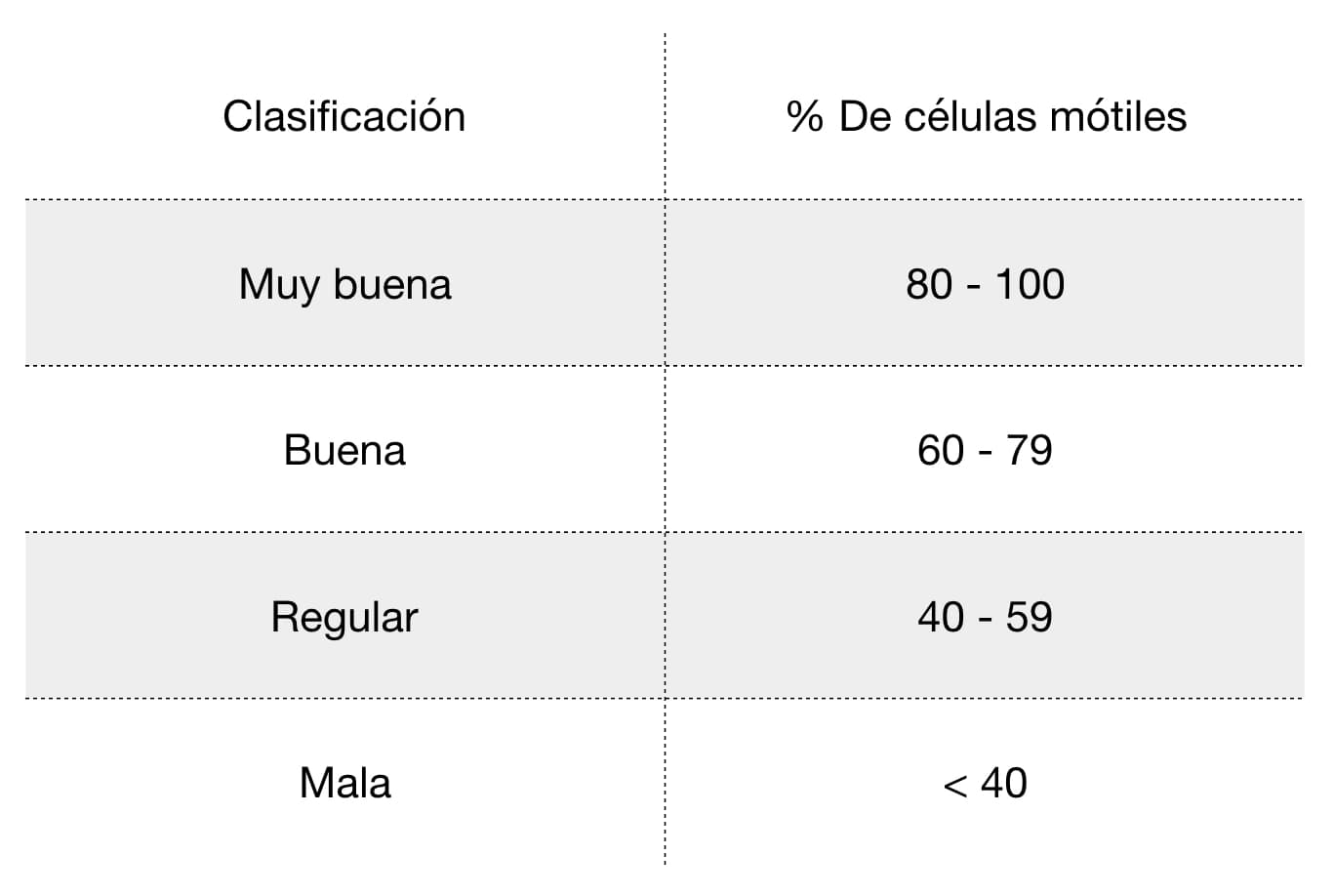
La motilidad masal se estima sobre la base del vigor de la onda de movimiento, asignando un puntaje en una escala que va de cero a cinco (cuadro 1).

La evaluación realizada para la motilidad masal se considera muy subjetiva, pero evaluadores expertos pueden hacer una estimación bastante confiable (video 2).
Motilidad individual progresiva
La motilidad individual ofrece una visión del movimiento progresivo rectilíneo de los espermatozoides, la motilidad está correlacionada positivamente con la concentración y el porcentaje espermatozoides viables y negativamente con el porcentaje de formas anormales; el valor de esta variable además, va a depender de la temperatura de evaluación y el tipo de diluyente utilizado.
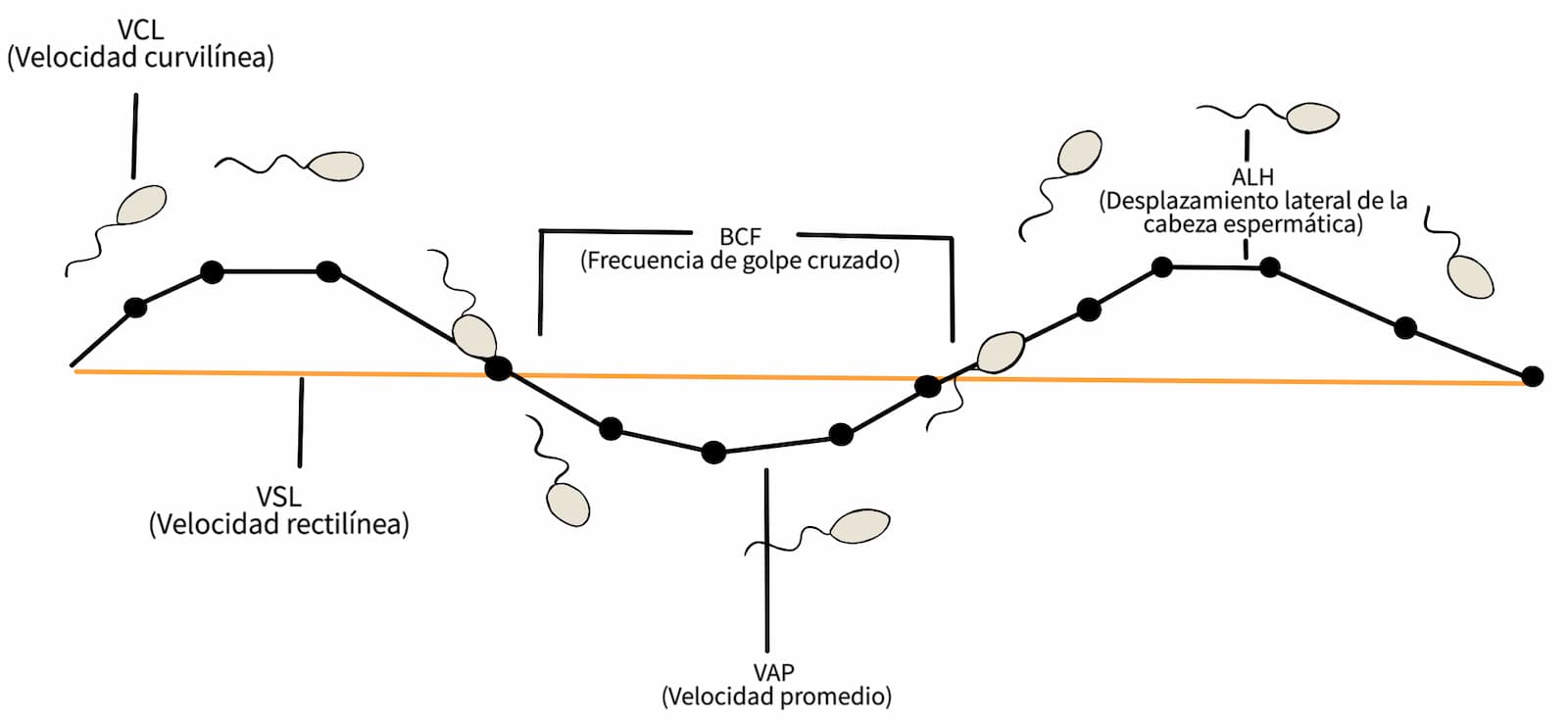
Para la evaluación de la motilidad individual se coloca una gota de semen en un portaobjetos, limpio y mantenido a 37 °C, observando 5 a 10 campos al azar en el microscopio con aumento de 40X, para así obtener un promedio cercano de la motilidad espermática real. La discriminación de la motilidad progresiva se debe hacer de acuerdo al porcentaje obtenido de esta evaluación (cuadro 2). La estimación visual de la motilidad es altamente subjetiva y sus resultados pueden depender en gran medida de la experiencia del observador, por lo que se han desarrollado sistemas de análisis de semen asistidos por computadora (Computer Assisted Sperm Analysis) CASA, que permiten mayor objetividad y la evaluación de un mayor número de parámetros para definir el movimiento de los espermatozoides (figura 31). Permite calcular el porcentaje de espermatozoides móviles y emite un informe donde se describen las particularidades de su movimiento.
Morfología espermática
El estudio de la morfología espermática es otra prueba importante de la contrastación rutinaria del semen. Se ha demostrado que es un indicador importante del descenso de la fertilidad en un gran número de especies animales.
Las anormalidades espermáticas significan que los espermatozoides no tienen la conformación de cabezas y/o colas deseables, en consecuencia su capacidad fecundante podría estar afectada en distintos grados. El semen ovino normalmente puede presentar de un 70 a un 90% de espermatozoides normales. Para poder observar las células se utilizan diferentes tinciones espermáticas, como azul de metileno o rosa de bengala. Entre las tinciones usadas para la evaluación de la morfometría se encuentran Diff-Quick recomendada por la OMS, Hematoxilina de Harris, Hemacolor y más recientemente se ha desarrollado la tinción SpermBlue tanto para humanos como animales.
Viabilidad espermática
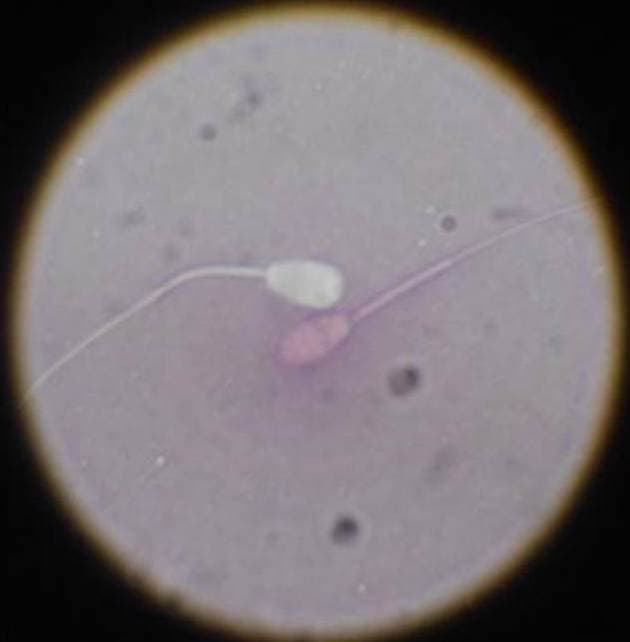
El porcentaje de espermatozoides vivos también es un parámetro a tener en cuenta, normalmente se puede encontrar el semen de machos adultos con 80 al 90% de espermatozoides vivos. También se pueden obtener eyaculados con más de 30 % de células muertas, esto puede indicar un detrimento en la fertilidad.
El porcentaje de espermatozoides vivos se puede determinar por medio de coloración. Las tinciones más utilizadas probablemente sean la de eosina-nigrosina (figura 32) y la de Tripan azul.
Ambas son tinciones de membrana impermeable, en las que aquellos espermatozoides que presenten una integridad estructural en su membrana no van a permitir la penetración del colorante; por lo tanto, los que aparezcan teñidos se considerarían muertos.
Integridad funcional de la membrana plasmática
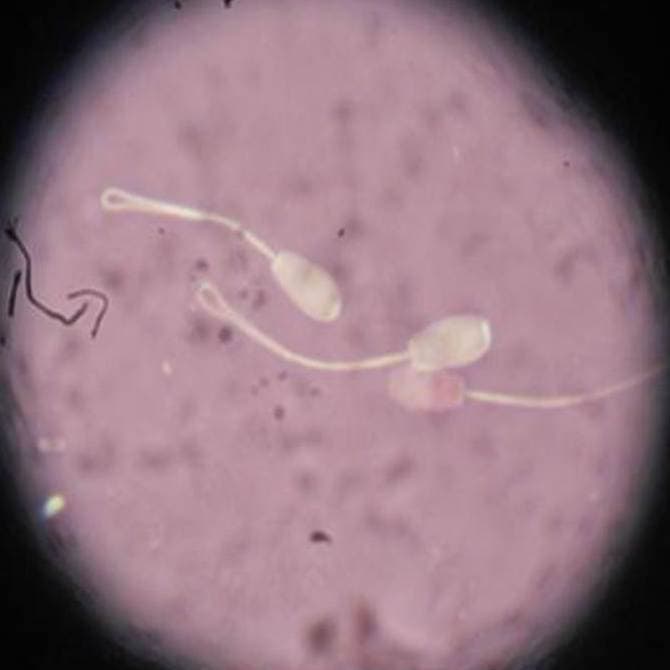
Se realiza mediante el Test de Endosmosis (Hypoosmotic Swelling test, Host); se trata de una técnica muy sencilla, que proporciona una referencia clara sobre la integridad funcional de la membrana plasmática. Se basa en la reacción que tienen las células ante cambios en la presión osmótica. Al incubar a 37°C durante 30-120 minutos una muestra de semen en un medio con una presión osmótica comprendida entre 50 y 150 mOsm/kg, inferior a la fisiológica (300mOsm/kg). La entrada de agua en la célula provoca, en aquellas con la membrana plasmática íntegra, un hinchamiento y enrollamiento del flagelo mientras que aquellas que presentan un daño en la misma no experimentaran estos cambios (figura 33).
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)