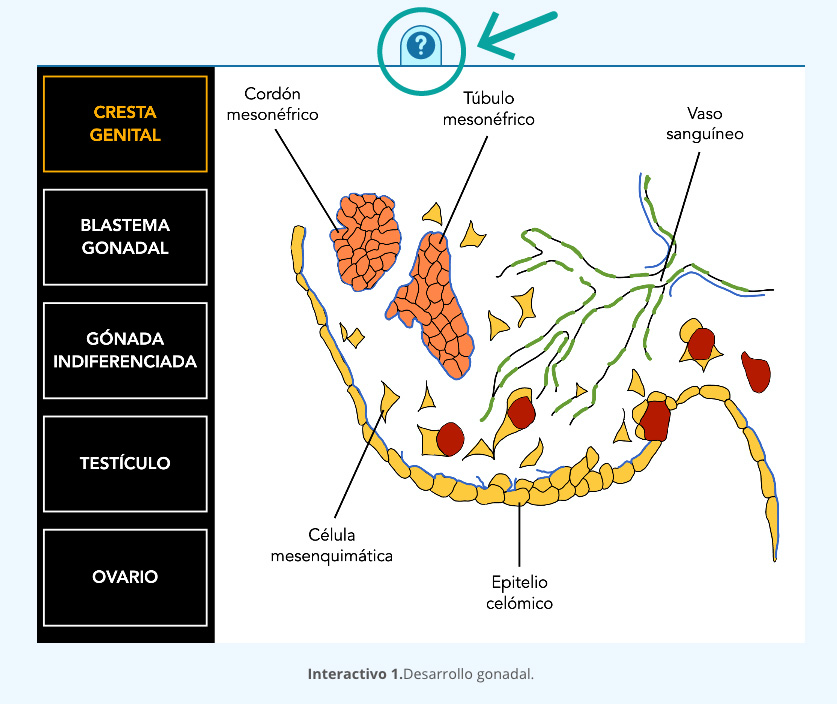
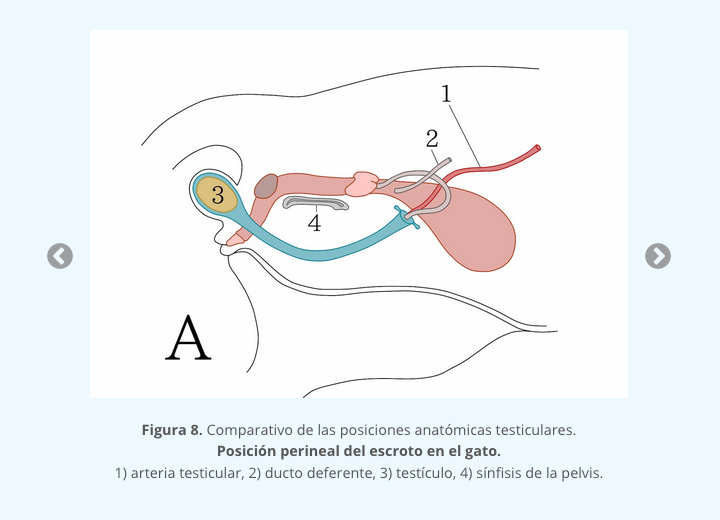
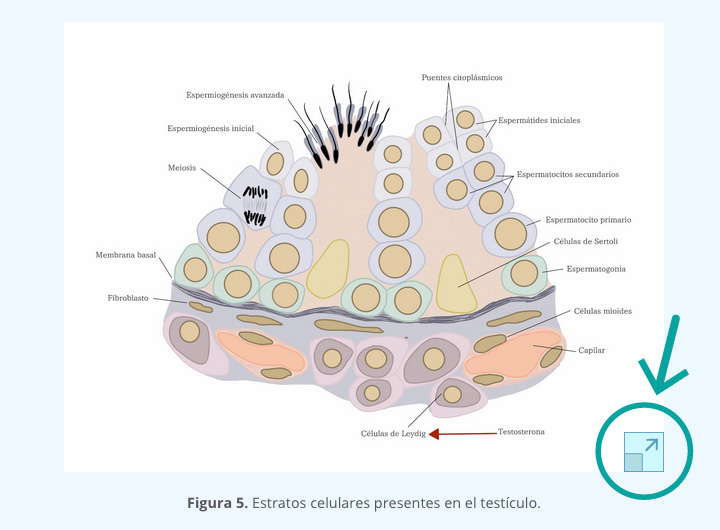
1.4 DETERMINACIÓN SEXUAL GONADAL
1.4.1 LA DETERMINACIÓN SEXUAL TESTICULAR
Para que la gónada primitiva se desarrolle como testículo es indispensable la presencia del cromosoma Y. El gen determinante del testículo, conocido como Sry en ratón y SRY (por sus siglas en inglés: Sex determining Region Y) en humanos, codifica para un factor de transcripción del mismo nombre (sry y SRY, respectivamente). El gen
El
Al igual que éste, el
En el ratón, la proteína SRY tiene como sitio blanco al potenciador o enhancer del
-
Iniciación: es regulada por la unión de
SF1 al potenciador de Sox9, lo que promueve una expresión moderada de Sox9. -
Sobreexpresión: la proteína del gen
SRY junto con la proteína SF1 interactúan sinérgicamente en el potenciador de Sox9, lo que incrementa los niveles de Sox9. En el ratón, la expresión de SRY y Sox9 en las células precursoras de Sertoli coincide por un periodo de seis horas en la cresta gonadal. -
Mantenimiento: En esta etapa
Sox9 regula de forma negativa la expresión de SRY. El mantenimiento de la expresión de Sox9 es crucial para la permanencia del testículo diferenciado, para lo cual, varios factores participan con la función de mantenimiento como es el caso de FGF9 y PGD2 sintasa.
Es importante destacar que para obtener los niveles elevados de
Aunque el enhancer TES se activa en respuesta a
Los potenciadores se ubican a 500 kb (kilobases) de distancia del potenciador TESCO. El primer potenciador llamado eSR-A Sex (Reversal Enhancer-A) tiene elementos de respuesta para
Existe una distancia considerable entre los tres potenciadores: 63 kb entre eSR-A y eSR-B y 555 kb entre eSR-B y eALDI, por lo que la formación de una asa en la cromatina (loop) entre los potenciadores podría regular la acción sinérgica sobre la expresión de
La proteína SOX9 tiene como blanco de regulación transcripcional a la hormona antimülleriana (AMH), la cual, contribuirá con la regresión de los conductos de Müller. Este aspecto será abordado con mayor detalle en la sección de la diferenciación de los conductos sexuales. Además de la cascada iniciada por
1.4.2 LA DETERMINACIÓN SEXUAL OVÁRICA
A diferencia del avance sobre las cascadas de expresión génica que regulan la determinación y diferenciación sexual del testículo, conocemos poco acerca de los mecanismos moleculares relacionados con el establecimiento del ovario. La cascada de señalización que controla la diferenciación ovárica depende de la expresión coordinada de varios factores como son: GATA 4 (Gata binding protein 4), WNT4 (wingless-related MMTV integration site 4), RSPO 1 (R-sponding homologue), CTNNB1 (beta- catenina) y FOXL2 (Forkhead box L2). Básicamente, la vía de señalización WNT4/ catenina junto con RSPO1 y FOXL2 antagonizan la cascada de expresión inducida por SOX9.
La deleción de WNT4 y FOXL2 o de RSPO 1 y FOXL2 únicamente lleva al desarrollo de ovotestis en lugar de testículos, indicando una reversión sexual parcial. Estos resultados sugirieron la existencia de otros factores que contribuyen a la diferenciación ovárica.
Así, FOXL2 codifica para un factor de transcripción que se expresa principalmente en ovarios, también lo hace en los párpados y la hipófisis. En humanos, su mutación lleva a la presencia del síndrome blefarofimosis-ptosis-epicanto inverso conocido bajo el acrónimo BPES. Los pacientes se caracterizan por presentar blefarofimosis (disminución de la apertura palpebral), ptosis (caída del párpado superior), telecanto y la infertilidad femenina caracterizada por la falla ovárica temprana. Por lo que el papel de FOXL2 en el ovario humano es fundamental en el mantenimiento de la reserva folicular. Sin embargo, en el caso de las cabras, la pérdida de la expresión de FOXL2 es suficiente para inducir la reversión sexual.
En los ratones adultos, se ha demostrado que la expresión de FOXL2 es importante para la formación folicular y el mantenimiento de la diferenciación ovárica. La deleción dirigida de FOXL2 promueve la expresión de SOX9 en los folículos antrales, trayendo consigo la reversión de las células foliculares hacia células de Sertoli. Esto provoca que el tejido ovárico adulto inicie un proceso de reversión sexual parcial recapitulando la red de señalización que ocurre en la gónada fetal, con cambios que incluyen el rearreglo de los folículos, asemejando túbulos seminíferos y las células esteroidogénicas del tejido estromático, incrementan la producción de andrógenos similar a las células de Leydig en el testículo (video 2). Es importante enfatizar la importancia de estos resultados en términos de la bipotencialidad que mantienen las células somáticas de la gónada, aún después de su diferenciación como ovario o testículo.