8.2 IMPLANTACIÓN
El endometrio es la capa más interna del útero, está conformada por varios grupos de células, las cuales son: epiteliales, del estroma, del sistema inmune y endoteliales pertenecientes al sistema circulatorio. Las células epiteliales del interior del útero se dividen en luminales (ubicadas frente al lumen uterino) y las que se ubican desde el estroma endometrial hacia la base del miometrio para formar las glándulas uterinas. Todas estas estructuras se someten a una remodelación constante, cíclica y dinámica bajo una estricta regulación hormonal.
Una de las funciones clave del endometrio, en la gestación, es implantar y nutrir al embrión para asegurar un parto exitoso. Paradójicamente, el endometrio es refractario a la implantación del embrión a lo largo del ciclo estral a excepción de una pequeña “ventana de tiempo” en la cual éste es preparado por estrógenos y progesterona, entonces, el embrión puede implantarse en casi cualquier tejido menos en el útero, a no ser que esté preparado por estas hormonas para recibirlo. Sin embargo, en caso de que el epitelio luminal del endometrio sufra daño, el embrión podrá implantarse, incluso, en ausencia del ambiente preparado por hormonas, esto sugiere que durante la mayoría del tiempo el epitelio endometrial es una barrera contra la implantación.
En un endometrio normal, la fase en la que el embrión puede implantarse, se alcanza tras las acciones secuenciales de estrógenos y progesterona. Este periodo dura entre 3 y 5 días en los primates y unas pocas horas en ratones. En esta etapa de receptividad, las células del epitelio luminal presentan protrusiones citoplasmáticas que son sitios de endocitosis y que, en especies como el ratón, rata, humano y conejo, se llaman pinópodos. Además, se presentan características similares a la inflamación, como un estroma endometrial edematoso, altamente vascularizado y glándulas grandes e intrincadas con altos niveles de secreción (video 1).
Así, en ese espacio de tiempo, se observan procesos similares a los de lesión celular. Es probable que el endometrio receptivo sea en realidad un tejido debilitado y el embrión reconozca este estado para poder fijarse.
En humanos, se ha observado que una respuesta inflamatoria débil y la inhibición de la activación del sistema de complemento son características del endometrio de mujeres con infertilidad y fallas recurrentes de implantación, de esta manera se sugiere que un endometrio debilitado o lesionado es un prerrequisito para la receptividad al embrión (figura 1).

El concepto de la receptividad uterina fue reconocido por primera vez en 1973 por Alexander Psychoyos quien realizaba experimentos de transferencia de embriones en modelos de roedores en pseudogestación y de implantación retardada sugiriendo que la capacidad de adhesión, por parte del embrión, es también un determinante crítico si no existe la sincronía entre el desarrollo embrionario y la preparación uterina. El resultado es una falla en la implantación que concluye en la reabsorción embrionaria o aborto.
Se pueden diferenciar dos periodos según el momento en el que ocurre la implantación: el periodo pre-implantatorio y peri-implantatorio.
En el pre-implantatorio se secreta prolactina y lactógeno placentario, el trofoblasto cambia de epitelio simple cúbico a epitelio cúbico biseriado. El periodo peri-implantatorio depende del grado de invasión del trofoblasto al endometrio (de acuerdo a cada especie) y culmina en la formación definitiva de la placenta.
8.2.1 RECONOCIMIENTO MATERNO
En un ciclo estral normal el cuerpo lúteo secreta oxitocina para estimular la síntesis de prostaglandina (PGF2α). La producción de PGF2α es dependiente de un determinado número de receptores para oxitocina presentes en las células endometriales, cuando los receptores llegan a un número suficiente, inicia una secreción pulsátil de esta hormona provocando luteólisis. Este mecanismo debe evitarse si se desea una gestación exitosa.
En la oveja y en la vaca el blastocisto, previo a la implantación, produce una proteína específica que provee la señal para prevenir la luteólisis. Inicialmente, a esta proteína se le conocía como “proteína trofoblástica ovina o bovina 1” (oTP-1 y bTP-1 respectivamente). Ambas proteínas pertenecen al grupo de interferones, la mayoría de estos son glicoproteínas no específicas producidas por los leucocitos, fibroblastos, linfocitos y células trofoblásticas; su principal función es antiviral y alteran la función de las células blanco. Debido a que las proteínas trofoblásticas oTP-1 y bTP-1 constituyen una clase separada de interferones, actualmente, se les conoce con el nombre de “Interferón τ ovino y bovino” (oIFN-τ y bIFN-τ respectivamente). El uso de la letra griega “τ” (tau) indica el origen trofoblástico de esta proteína.
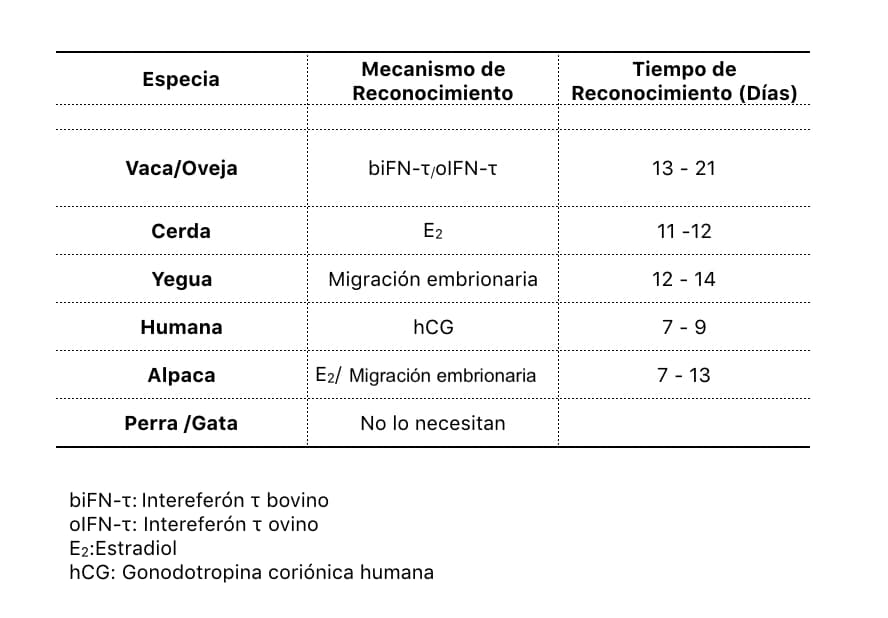
En ovejas, esta proteína es secretada por el trofoblasto del blastocisto desde el día 13 al 21 post ovulación. Su función principal es inhibir la síntesis de receptores para oxitocina en el endometrio (figura 2).

Adicionalmente, el IFN-τ se une a la glándula uterina y promueve la síntesis de proteínas que participan en la nutrición embrionaria.
El reconocimiento materno en otras especies es diferente al del ovino y bovino. En la cerda, por ejemplo, se presenta de la siguiente manera: el embrión comienza la producción de estradiol entre los días 11 y 12 después de la ovulación, este estrógeno no disminuye la producción de PGF2α, en cambio es redireccionada hacia el lumen uterino, teniendo así, un destino diferente al del ciclo normal (figura 3).
Este mecanismo aún no es completamente entendido, pero se cree que el estradiol fetal estimula la síntesis de receptores para prolactina en el endometrio. La acción de la prolactina hace que cambie el flujo iónico del calcio lo que provoca el cierre de canales que facilitan el paso de la PGF2α hacia los capilares uterinos, de esta manera, tenemos una secreción exocrina y no endocrina de PGF2α. Es posible que la acción de la PGF2α exocrina esté relacionada con las contracciones uterinas que permiten la distribución de los embriones a lo largo del cuerno uterino.
En las yeguas, la secreción de PGF2α se reduce significativamente con la presencia del embrión previniendo la luteólisis. La única característica del reconocimiento materno en yeguas es que el embrión migra de un cuerno uterino al otro. Esta migración ocurre entre los días 12-14 de gestación y parece ser necesaria porque el embrión equino no se alarga como en otras especies y el contacto con el endometrio es menor pero su migración por los cuernos uterinos compensa su tamaño. Es posible que el embrión equino libere sustancias que participen en el reconocimiento materno pero aún no están claramente identificadas (figura 4).
Los camélidos sudamericanos presentan un mecanismo mixto de reconocimiento materno. Los embriones de alpacas presentan elevada síntesis y secreción de estradiol similar a la cerda pero, al mismo tiempo, el embrión migra de un cuerno al otro lo que es equivalente al mecanismo en la yegua con la diferencia que en camélidos el embrión sí sufre elongación, alargándose durante su recorrido y no mantiene su forma como en los equinos. En alpacas se ha detectado este mecanismo aproximadamente entre el día 7 y 13 de gestación.
En mujeres, el embrión libera hCG (gonadotropina coriónica humana) aproximadamente en el día 7 - 9 después de la ovulación. Esta hormona tiene acciones similares a la LH (hormona luteinizante) y actúa sobre el cuerpo lúteo evitando la luteólisis. El mecanismo por el cual la hCG evita la luteólisis no está completamente claro pero su acción luteotrópica es suficiente para permitir la implantación y el mantenimiento de la gestación.
En perros, el cuerpo lúteo de la gestación tiene la misma vida media que el cuerpo lúteo del ciclo estral, por lo que no se requiere que el embrión tenga alguna característica especial para que sea reconocido por la madre. En otras palabras, la duración del diestro es muy similar a la duración de la gestación por lo que la lisis del cuerpo lúteo sucede muy cerca del fin del período de gestación.
Por otro lado, la gata, al ser de ovulación inducida necesita la cópula para la formación del cuerpo lúteo y éste, al igual que en los cánidos, tiene la misma duración que su período gestacional. Es decir, su cuerpo lúteo no se lisa antes de la implantación de los embriones (cuadro 2).
.jpg)
.jpg)