4.3 FISIOLOGÍA DEL MACHO
Las funciones primordiales del testículo son la producción de gametos sexuales y hormonas que van a apoyar el proceso exitoso de inicio y mantenimiento de la espermatogénesis, diferenciación sexual, desarrollo reproductivo y comportamiento sexual en el macho. Estas funciones están reguladas directamente por el sistema nervioso central a través del eje hipotálamo-hipófisis-gonadal y de manera indirecta por otras hormonas como kisspeptina y leptina, que en conjunto pueden actuar a nivel hipotalámico regulando la fertilidad en los animales.
4.3.1 CONTROL DE LA FUNCIÓN TESTICULAR
4.3.1.1 REGULACIÓN DE LA FUNCIÓN TESTICULAR DURANTE EL DESARROLLO FETAL
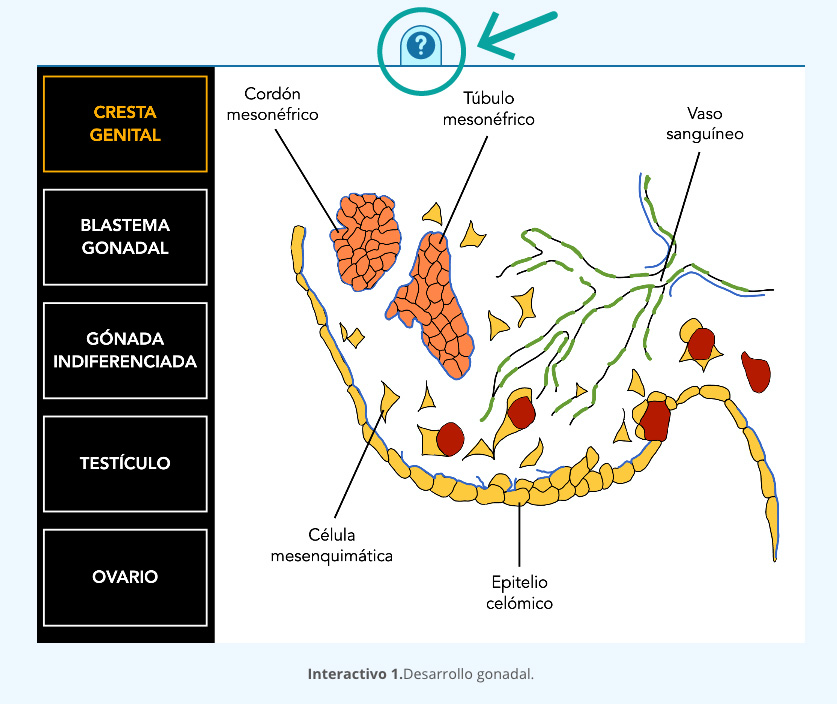
Después de la fertilización, el embrión continúa su división celular hasta la estructura de blastocisto y a partir del epiblasto se formarán las tres capas germinales: ectodermo, el endodermo y el mesodermo que darán origen a diferentes sistemas de órganos. En este momento, la mayoría de las células del epiblasto dejan de ser pluripotentes a excepción de las células germinales primordiales que se derivan del revestimiento interno del saco vitelino (figura 12) (cuadro 1).

Estas células van a migrar del mesonefros y se van a localizar en las crestas gonadales para formar las gónadas indiferenciadas (interactivo 2).

En el feto bovino se han detectado hasta 2.000 células germinales primordiales en la cresta gonadal en el día 25 de gestación.
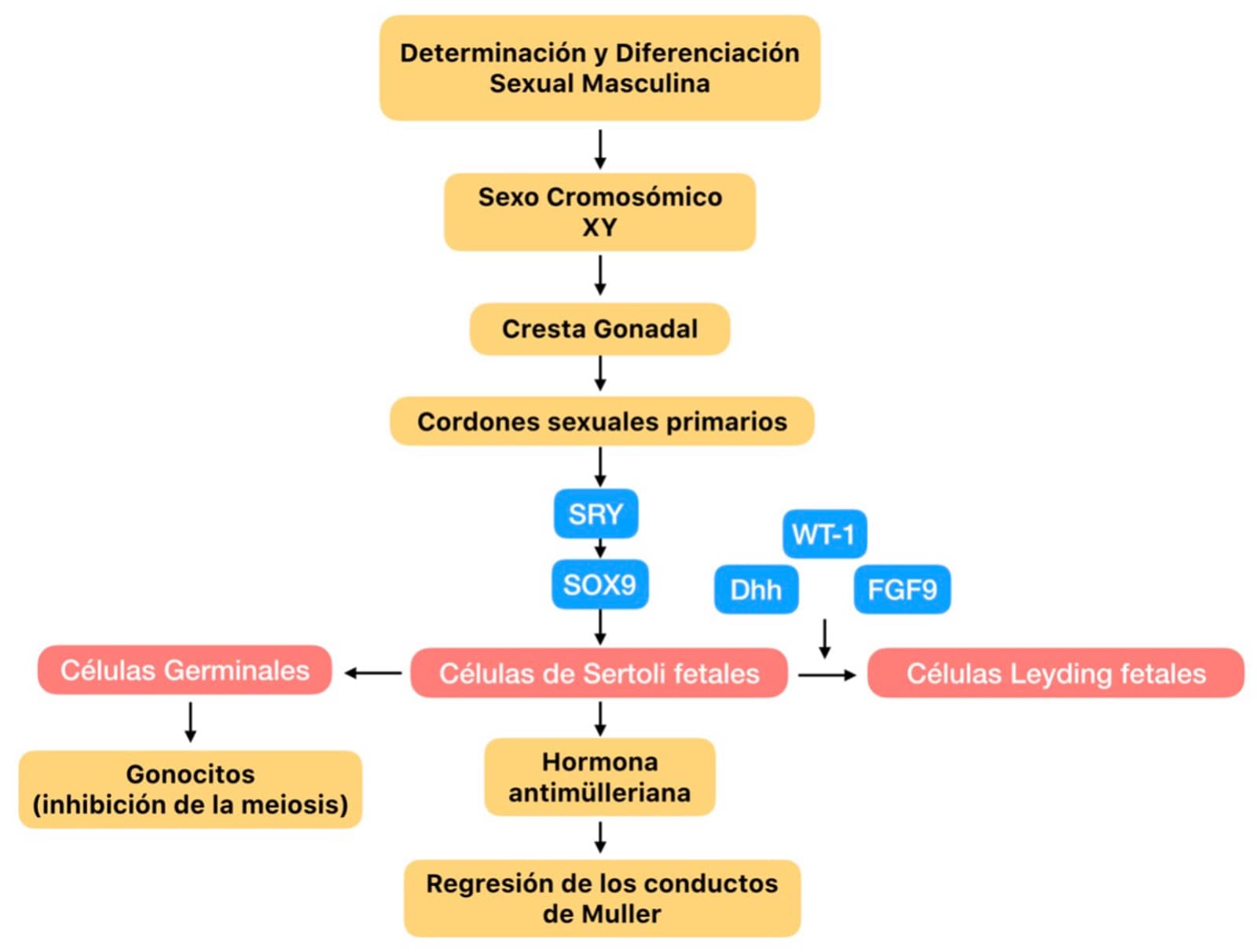
La expresión genética, del cromosoma Y (gen SRY), que ha sido determinada en el momento de la fertilización por el espermatozoide fecundante, es el que desencadena una serie de eventos morfo-genéticos que determinan el desarrollo y diferenciación hacia una gónada de macho a partir de la gónada indiferenciada; y que en ausencia del cromosoma Y, la gónada se diferenciará hacia una hembra. Esto se logra, debido a que el gen SRY es un factor de transcripción con capacidad de regular otros genes como SOX9, quien conduce a la diferenciación de las células de Sertoli en etapa fetal. La proteína WT-1, el factor Dhh y FGF9 expresados en las células de Sertoli son importantes para la diferenciación a células de Leydig y otros linajes celulares que facilitan la formación del compartimento testicular.
Por otro lado, la producción de la hormona antimülleriana por las células de Sertoli fetales, provocan la regresión de los conductos Müllerianos, estructuras que permanecen en las hembras y son precursoras de útero, trompas uterinas u oviductos y tercio superior de vagina (figura 13).
Los embriones macho, mantienen los conductos de Wolff (mesonéfricos) que se diferenciarán en epidídimo, conductos deferentes, vesícula seminal y conducto eyaculador. La producción de hormonas fetales son tres: andrógenos (hormona esteroide), hormona antimülleriana (proteína) y factor parecido a la insulina tipo 3 (INSL3, hormona proteica). En este sentido, la secreción de testosterona por las células de Leydig fetales, alrededor del día 30 en ovinos y 42 en bovinos, dirige a cambios en la anatomía genital externa y función neuroendocrina hacia un fenotipo masculino. De modo que, la exposición a testosterona estimula el desarrollo de los conductos aferentes y deferentes, ductos del epidídimo y vesículas seminales, a partir de los túbulos del mesonefros. Simultáneamente, la conversión de testosterona a dihidrotestosterona promueve la diferenciación sexual externa, con la formación de la próstata, glándulas bulbouretrales, escroto y el falo (figura 14). Tomando en cuenta el papel tan importante que tienen los andrógenos para el desarrollo sexual y la función reproductiva, un exceso o falta de testosterona durante la vida fetal, se puede ver reflejado en la fertilidad del animal después del nacimiento.
El eje hipotálamo hipófisis gonadal es funcional después del periodo diferenciación genital externa o masculinización y el incremento de niveles de andrógenos en el plasma, en la mayoría de las especies. Por lo que, las gonadotropinas hipofisiarias no son necesarias para la actividad inicial de las células de Leydig fetal, aunque respondan a la LH desde una etapa temprana (interactivo 3).
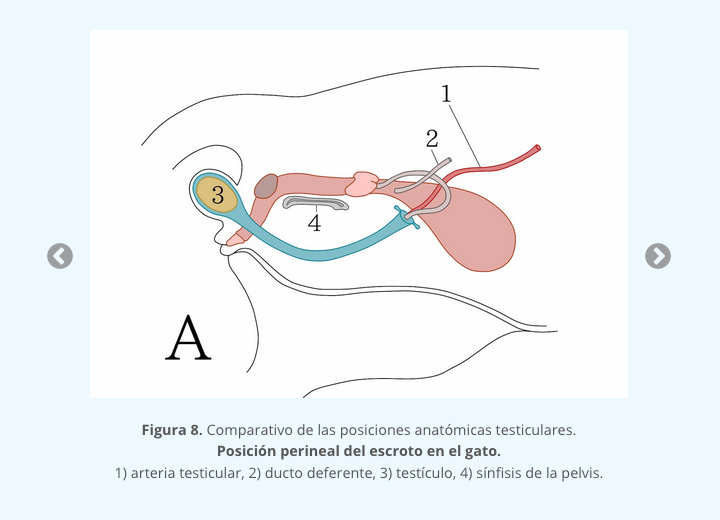
El descenso testicular se lleva a cabo en dos fases: la primera, descenso trans-abdominal, mediado por el factor parecido a la insulina tipo 3 (INSL3) y andrógenos producidos por las células de Leydig; la segunda fase, el descenso inguino escrotal, depende principalmente de los andrógenos y otros factores como el péptido relacionado con la calcitonina (CGRP) y el factor homético HOXA10 (interactivo 4). En bovinos, el criptorquidismo se asocia más a una predisposición hereditaria que a una mutación del gen INSL3. El tiempo del descenso testicular varía en las diferentes especies domésticas, siendo más precoz en los bovinos (día 80-90 de gestación) que en los equinos, en donde puede presentarse incluso 2 semanas después del nacimiento.
Las neuronas de hormona liberadora de gonadotropinas (GnRH) son producidas fuera del Sistema Nervioso Central (SNC) y son detectadas originalmente en la región nasal antes de aparecer en el cerebro.
La población de células GnRH, toma origen en la placoda olfatoria y migra durante el desarrollo a través del SNC vía los axones de las neuronas olfativas, los bulbos y tractos olfativos, hasta alcanzar su localización definitiva en el hipotálamo.
Distintos genes están encargados del desarrollo y migración (KAL1, Kallmann syndrome 1 sequence; FGFR1, fibroblast growth factor receptor; FGF8, fibroblast growth factor 8; PROKR2, prokineticin receptor 2; PROK2, prokineticin 2; CHD7, chromodomain helicase DNA binding protein 7; NELF, nasal embryonic LHRH factor), homeostasis y secreción de GnRH (DAX1, dosage-sensitive sex reversal, adrenal hypoplasia congenital critical region on the X chromosome, gene 1; PC1, prohormone convertase; LEPR, leptin receptor; LEP, leptin; KISS1R, KISS1 receptor; TACR3, tachykinin receptor 3; TAC3, tachykinin 3; GNRH1, gonadotropin-releasing hormone 1) y estimulación de los gonadotropos en la hipófisis (GNRHR, GnRH receptor y DAX1) (interactivo 5). La imposibilidad de las neuronas GnRH para migrar correctamente da como resultado hipogonadismo hipogonadotrópico e interrumpe la maduración sexual en ratones y humanos. En humanos se ha descrito que defectos en la migración asociada a la ausencia del bulbo olfatorio (Síndrome de Kallman), promueven un menor desarrollo de los gonadotropos de la pituitaria e incapacidad para sintetizar hormona luteinizante (LH) y hormona folículo estimulante (FSH).
4.3.1.2 REGULACIÓN DE LA FUNCIÓN TESTICULAR DESPUÉS DEL NACIMIENTO.
La función testicular está bajo el control del sistema nervioso central, a través de las gonadotropinas hipofisiarias LH y FSH, que actúan sobre sus receptores específicos localizados en las células de Leydig y Sertoli, respectivamente. La biosíntesis y secreción de LH y FSH está regulada por GnRH, que se sintetiza en el hipotálamo y viaja a la hipófisis a través del sistema porta hipofisiario, en donde se une a su receptor de membrana localizado en los gonadotropos de la hipófisis. Aunque la GnRH pareciera no ser fundamental para el desarrollo gonadal en el feto, a partir de la pubertad la función de GnRH es de gran relevancia para los procesos de espermatogénesis, esteroidogénesis y las reacciones de retroalimentación que se ejercen sobre las hormonas esteroides producidas en las gónadas (figura 15).
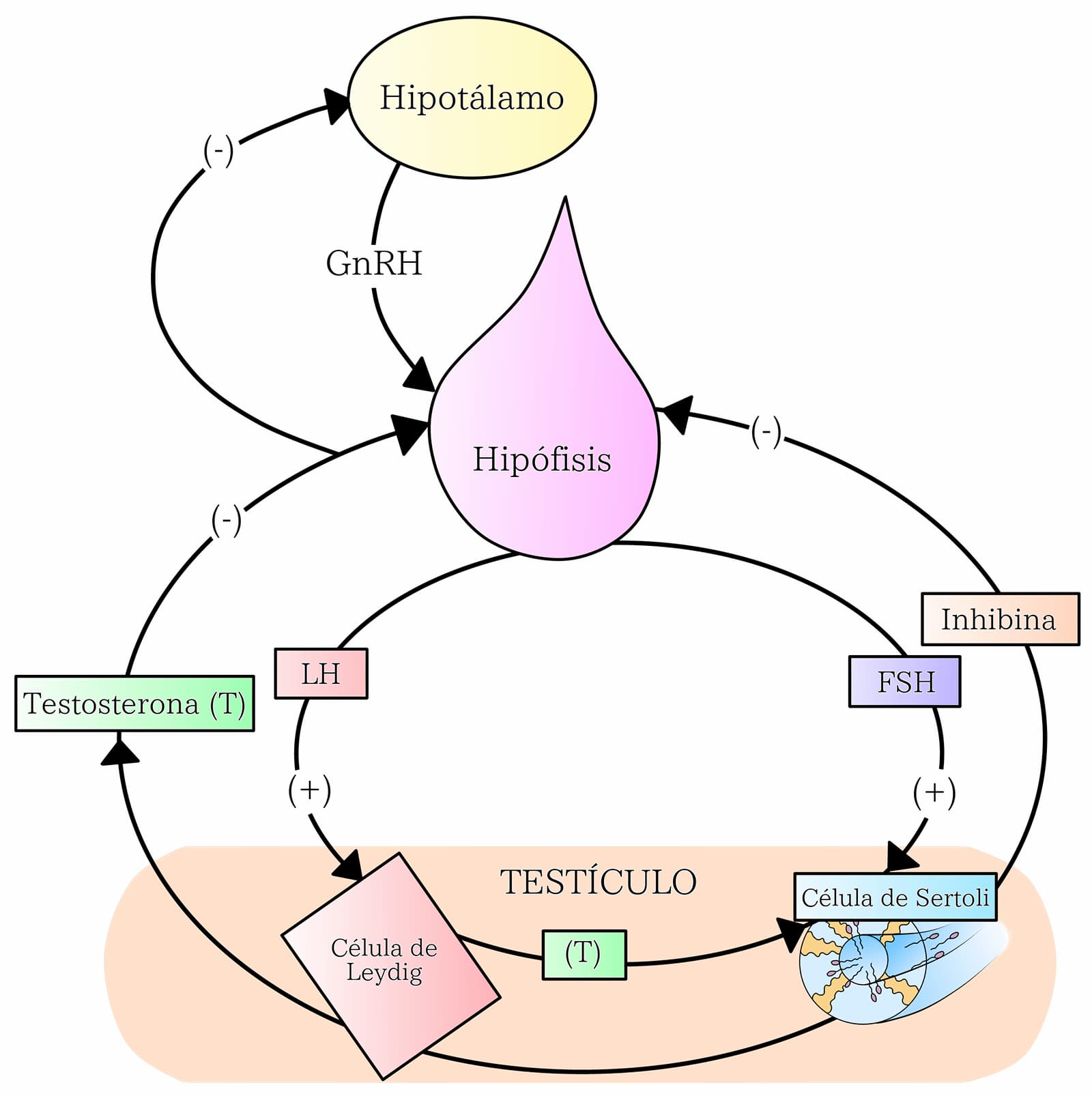
La GnRH es secretada a través de dos modos distintos: pulsátil y en oleadas; esta última solo se presenta en las hembras. El centro generador de los pulsos de GnRH está localizado en el núcleo arcuato y es activado desde la vida fetal una vez que se alcanza la migración de las neuronas de GnRH hacia el hipotálamo. Sin embargo, los pulsos de GnRH permanecen suprimidos o en quiescencia desde el nacimiento a la etapa prepuberal. Una vez alcanzada la pubertad, la actividad pulsátil de GnRH es la función más notable y es la que más se ha estudiado.
El generador de impulsos GnRH se basa en relaciones complejas entre neuronas que contienen norepinefrina, ácido gamma-aminobutírico (GABA), dopamina, serotonina, glutamato, neuropéptido Y (NPY) y galanina, todos ellos neurotransmisores. La norepinefrina y dopamina se encuentran clasificados como catecolaminas (derivados del aa tirosina); la serotonina se incluye con las indolaminas (descritas anteriormente). Algunos neurotransmisores como el glutamato y la norepinefrina presentan una función estimuladora; mientras que otros, como el GABA, ejercen una función inhibitoria de los pulsos de GnRH. Adicionalmente, y de modo crucial, el control de la pulsatilidad y liberación de GnRH está regulado por otras vías, tales como la señalización de kisspeptina, neuroquinina y B-opioide (dinorfina), y por lo tanto participan en el control central de la reproducción de mamíferos (figura 16).

4.3.1.2.1 REGULACIÓN DE LA PRODUCCIÓN DE GNRH EN EL MACHO
La regulación de producción y liberación de GnRH en el macho está mediada por neurotransmisores inhibidores y estimuladores, así como por vías de señalización mediadas por péptidos como kisspeptina, neuroquinina y B-opioide. La kisspeptina, es un péptido producto del gen Kiss1, aislado en 1996 en Hershey, EUA; se tomó ese nombre por los chocolates “Kisses” producidos en esa ciudad. Este péptido cuenta con un cadena de 52-54 aa que están conservados en la mayoría de los animales domésticos. La kisspeptina tiene un ligando endógeno el GPR54, que es un receptor acoplado a proteína G, y se localiza en varios tejidos del organismo como cerebro, hipófisis, placenta, gónadas, tracto gastrointestinal, hígado y el sistema vascular. Una vez que la kisspeptina se une a su receptor, activa la fosfolipasa C y mensajeros intracelulares como el inositol trifosfato y diacilglicerol, que a su vez conducen a la liberación de calcio y la activación de PKC. La kisspeptina es un potente estimulador de la síntesis de GnRH, que controla tanto la secreción pulsátil de GnRH involucrada en la foliculogénesis, la espermatogénesis y la esteroidogénesis, como en la secreción en oleada de GnRH en la ovulación en la hembra (figura 17).
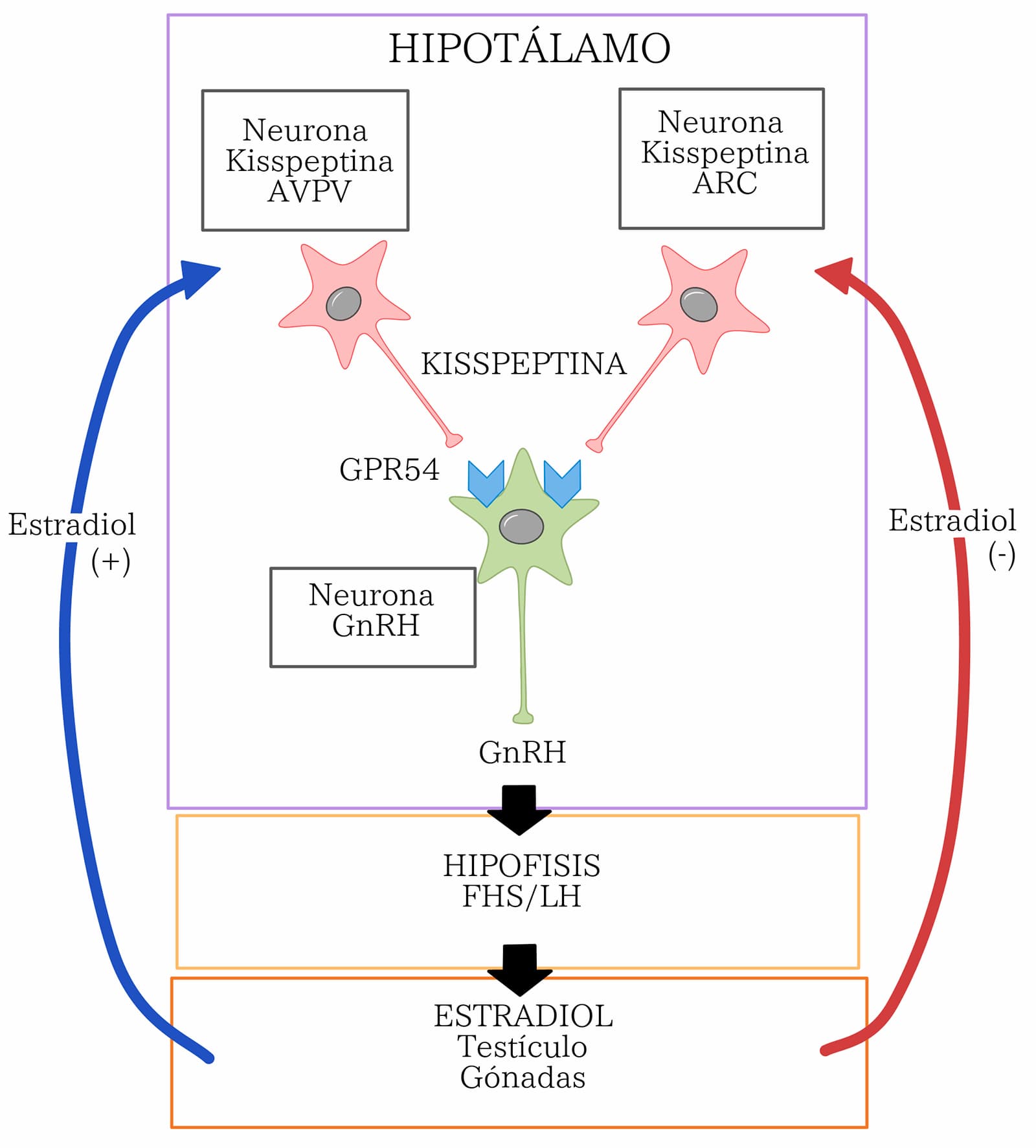
El uso de kisspeptina exógena, en específico kp-10, activa neuronas de GnRH y parece tener más efecto sobre la secreción de LH que de FSH, con una notable variación entre especies de animales domésticos y formas en vías de administración.
La falta del receptor de GnRH, GPR54, promueve un tamaño gonadal reducido en los machos, con bajos niveles de gonadotropinas y hormonas esteroides y, en ratones, no logran llegar a la pubertad. Sin embargo, cuando existen mutaciones de este receptor, se ha asociado a hipogonadismo hipogonadotrópico idiopático en humanos y roedores, en donde la función testicular se pierde.
Además de las funciones hipotalámicas anteriormente descritas de la kisspeptina y su receptor, ésta también participa en el desarrollo y progresión de células somáticas y germinales, así como en las funciones de los espermatozoides en varios modelos de animales estudiados. Por lo tanto, para el desarrollo de nuevas estrategias para el manejo de la fertilidad en animales domésticos se deben considerar las funciones de kisspeptina.
Otra hormona involucrada en la regulación de GnRH es la leptina. La leptina es producida en tejido adiposo, codifica para el gen Lep y actúa a través de su receptor, con varias isoformas. Está relacionada con la disminución del apetito y con el gasto de energía. Sus niveles de expresión son altos en personas obesas. La leptina estimula la expresión de GnRH y promueve la secreción pulsátil de LH, a pesar de que las neuronas de GnRH no muestran receptores a leptina. Por lo tanto, se sugiere que sus efectos sobre la función reproductiva son de tipo indirecto. Algunas de las propuestas son a través de la estimulación de las neuronas de kisspeptina, quienes sí presentan receptores a leptina. Niveles anormales de leptina, están asociados a hipogonadismo hipogonadotrópico y problemas de fertilidad en machos.
4.3.1.2.2 FUNCIONES Y REGULACIÓN DE LAS GONADOTROPINAS (LH Y FSH) EN EL MACHO
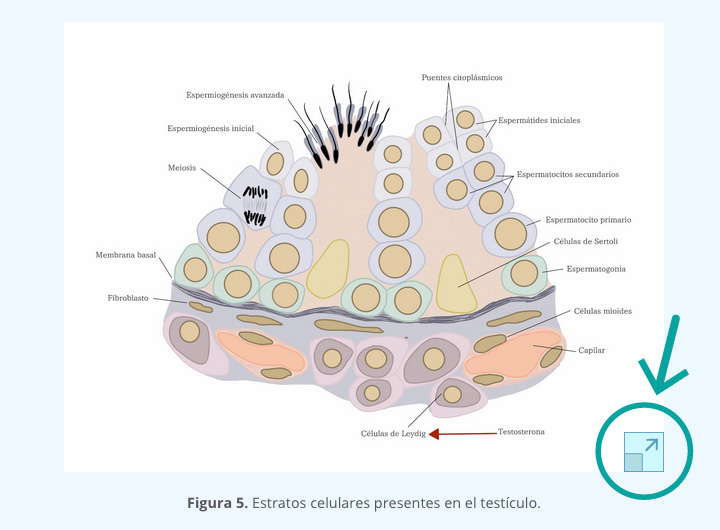
En las células de Leydig, la LH estimula la síntesis andrógenos, siendo el más representativo la testosterona a partir del colesterol. La testosterona formada es llevada a las células de Sertoli que forman parte de los túbulos seminíferos y, por influencia de FSH, estimula a la enzima aromatasa que se encarga de transformar la testosterona en estradiol (figura 18).

Adicionalmente, el efecto de LH sobre la función de las células de Leydig puede ser potencializada por la influencia de otras hormonas, como la Prolactina (PRL). Cuando hay deficiencia de PRL se produce infertilidad y regresión testicular, y cuando se aumentan los niveles de prolactina a través de terapias controladas, se estimula la espermatogénesis y se restablecen los niveles de testosterona en plasma. Sin embargo, cuando los niveles de PRL son muy altos en el plasma sanguíneo, se inhibe la función testicular y produce hipogonadismo.
La FSH estimula la proliferación de las células de Sertoli y su acción principal, junto con la testosterona, es el mantenimiento de la espermatogénesis. Una vez que la FSH se ha unido a su receptor específico de membrana en las células de Sertoli, promueve la producción de inhibina. Esta hormona, va a realizar una retroalimentación negativa a nivel de la hipófisis para disminuir la secreción de FSH. Adicionalmente, la inhibina tiene una actividad antagónica con otra hormona: la activina. La activina tiene la función de estimular la biosíntesis y secreción de FSH y sus funciones están moduladas por la folistatina, hormona que también es conocida como una proteína de unión a la activina. Por el entendimiento de unirse a las subunidades de activina, bloquea de manera local sus interacciones con los receptores y de esta manera la folistatina promueve un efecto inhibidor sobre la liberación de FSH (figura 19).
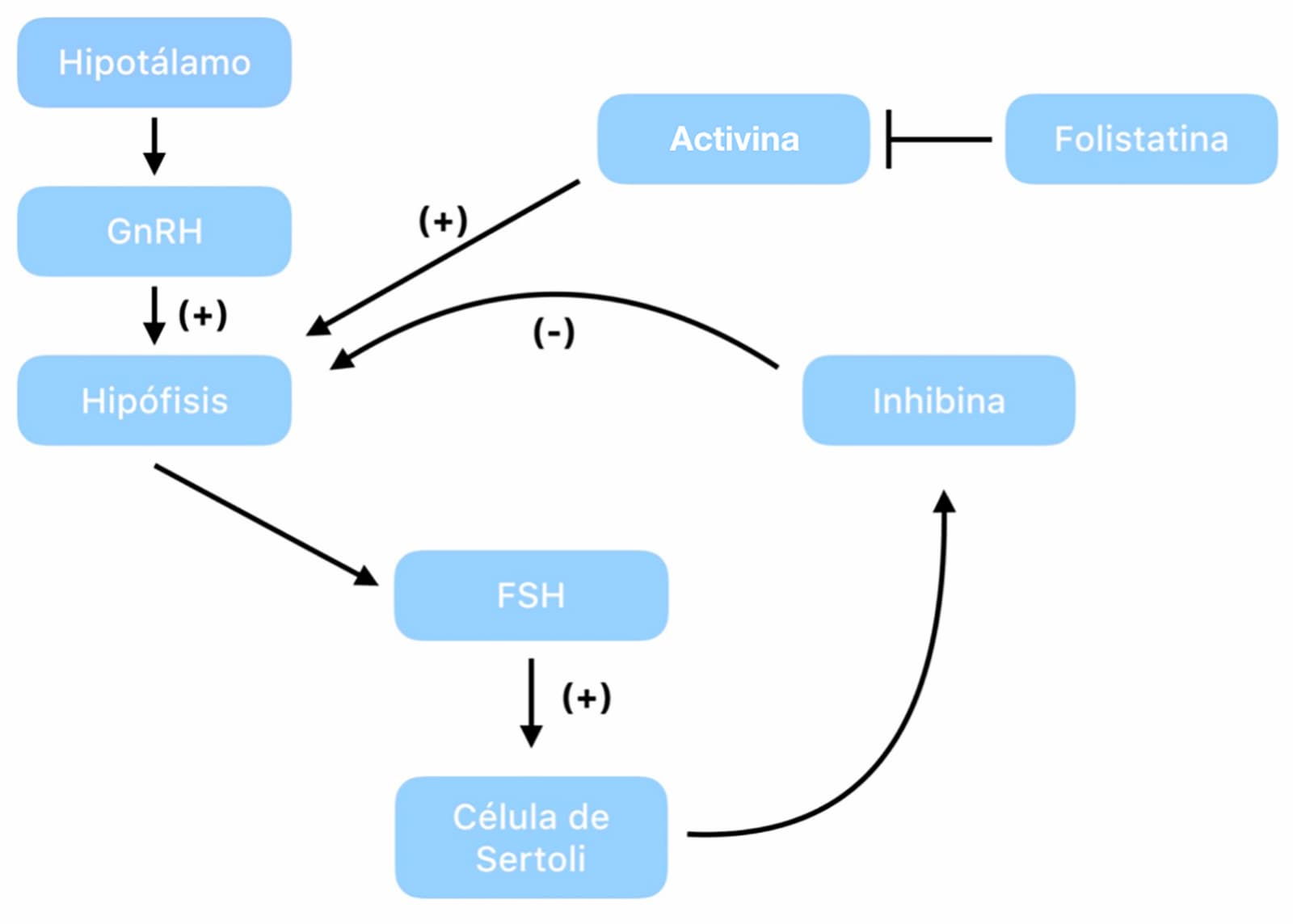
Estas hormonas glicoproteicas, pertenecen a la superfamilia del factor de crecimiento transformante-β (TGF-β), y constituyen el sistema inhibina-activina-folistatina regulando la función de FSH. Con excepción de la inhibina, la activina y la folistatina se expresan en todos los niveles del eje hipotálamo-hipófisis-gonadal y además también están presentes en varios tejidos no reproductivos, en donde realizan diversas funciones fisiológicas del organismo a través de un papel de tipo paracrino o autocrino. Por consiguiente, animales castrados muestran una disminución drástica de inhibina, no así de activina y folistatina debido a que estas se producen en otros tejidos a parte del tejido testicular.
La función de FSH difiere entre especies. En ratones adultos, una deficiencia de receptores de FSH causa reducción del número de células de Sertoli y del tamaño testicular. Por el contrario, los hombres que carecen de FSH son infértiles y manifiestan azoospermia que es una ausencia de espermatozoides en el eyaculado y/o oligozoospermia con una baja cantidad de espermatozoides.
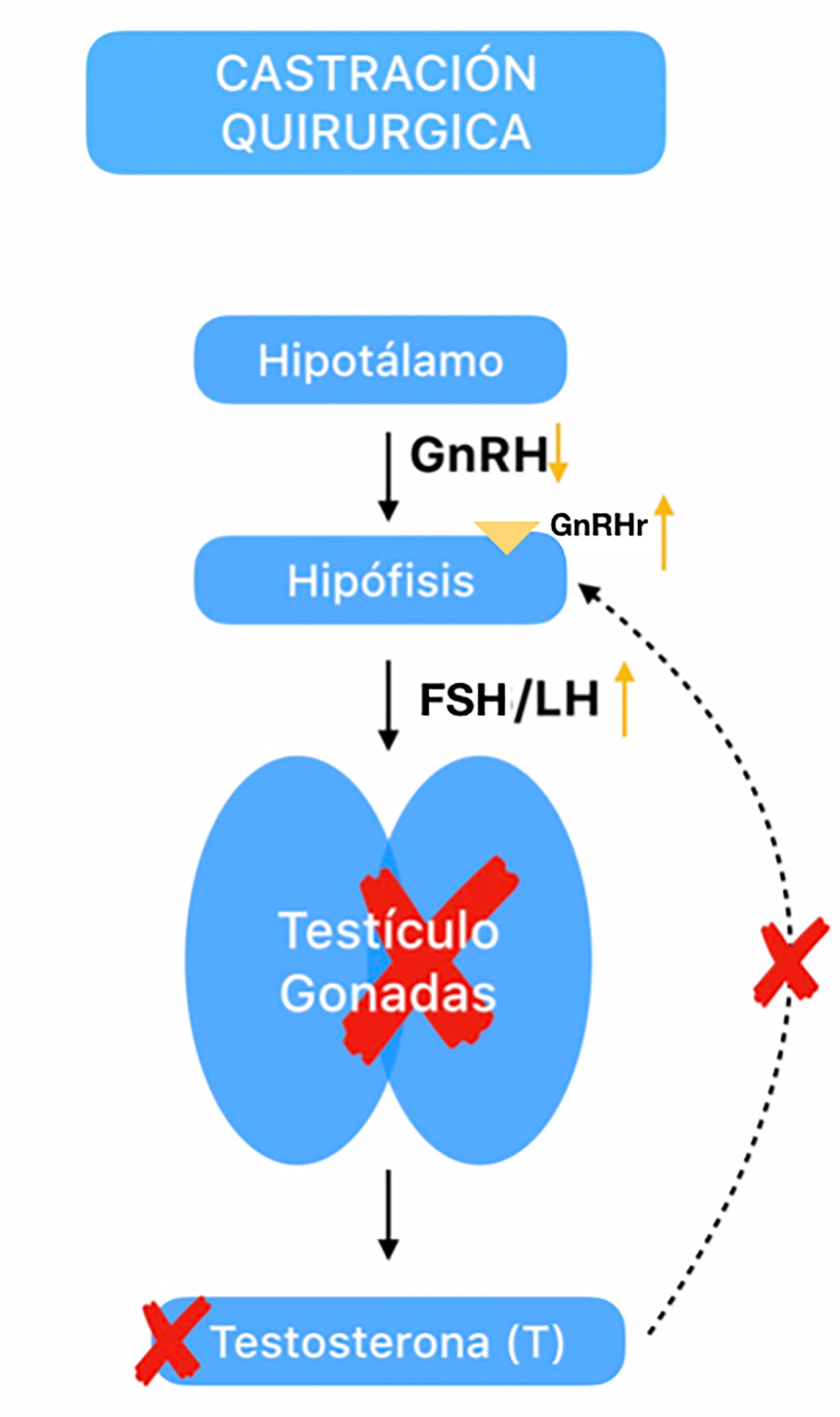
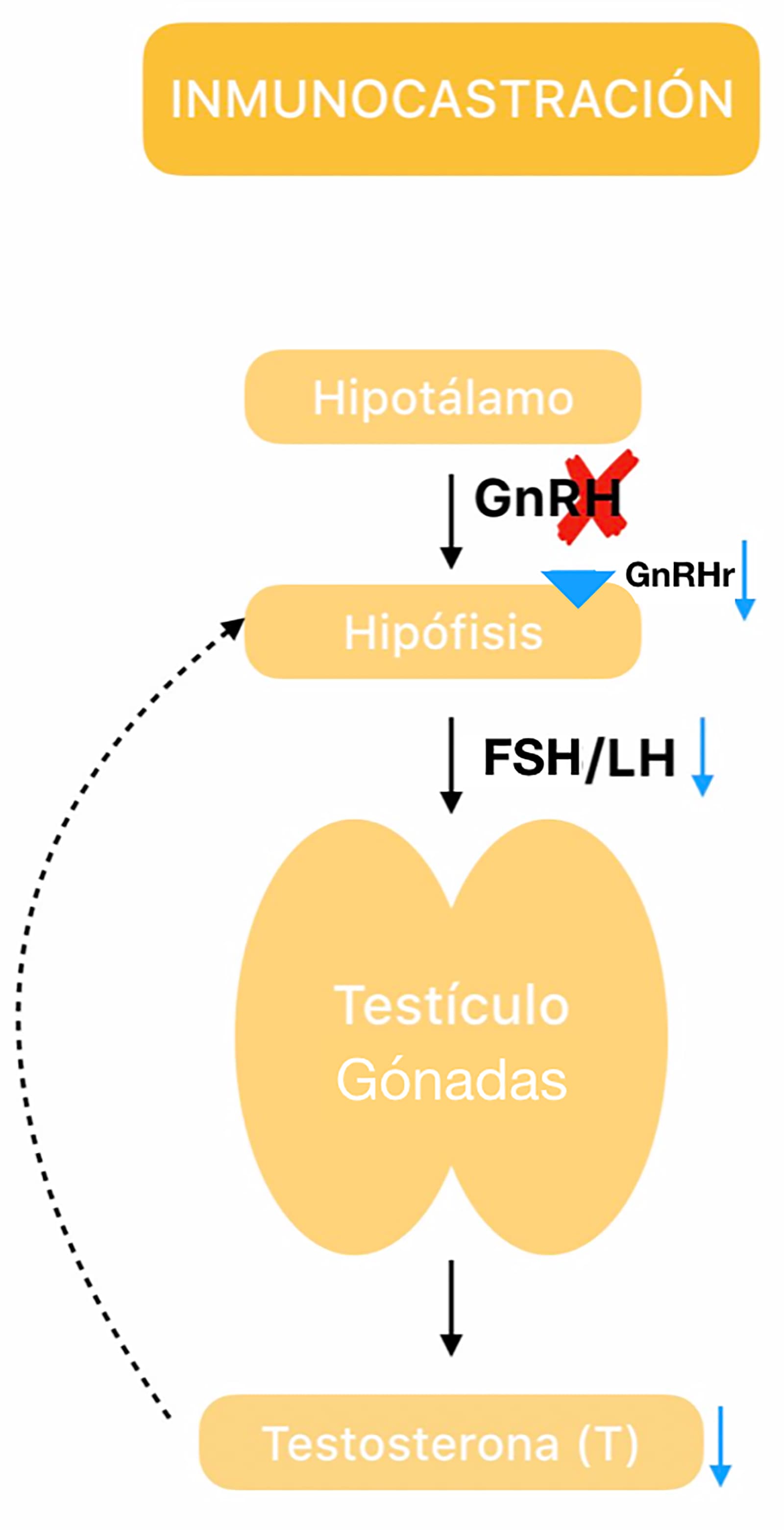
Actualmente en la industria pecuaria (principalmente en cerdos), se promueve la atrofia testicular, para evitar el manejo de la castración principalmente y en algunos casos para promover un tipo especial en calidad de carne. Esto se logra a través de la inmunización contra GnRH, la cual causa una función testicular inhibida porque no recibe los estímulos adecuados por las gonadotropinas (figura 20).
La testosterona se ajusta a un ritmo circadiano, con concentraciones mínimas por la tarde y concentraciones máximas por la mañana. Al ser una hormona lipofílica, solo el 2% está libre ejerciendo su función biológica y el 98% restante se transporta unida a proteínas, principalmente a la globulina transportadora de hormonas sexuales que es producida por el hígado. Otra proteína transportadora en menos proporción es la albúmina, quien junto con el 2% libre constituyen lo que se conoce como testosterona disponible.
Para mantener una concentración adecuada de testosterona en el epitelio de los túbulos seminífero, a nivel local, las células de Sertoli sintetizan una proteína fijadora de andrógenos (ABP), la cual se segrega a la luz de los túbulos y transporta la testosterona. De esta manera se mantiene una función normal del epitelio que reviste los túbulos eferentes y el epidídimo y así se pueda concluir el proceso de espermatogénesis.
Otra función de la testosterona es la formación de fructosa por las vesículas seminales; éstas últimas, junto con la próstata, también se encargan de la producción de ácido cítrico en el toro, carnero y humano, útiles en la motilidad y supervivencia de los espermatozoides.
Además de las funciones de los andrógenos producidos por las células de Leydig, que se mencionaron anteriormente, los andrógenos y sus metabolitos también tienen funciones fisiológicas específicas en el comportamiento reproductivo del macho y en muchos otros tejidos, por ejemplo: en los huesos, laringe, piel, riñones, hígado, músculo y cerebro.
El comportamiento reproductivo del macho involucra la producción de feromonas, vocalizaciones, jerarquía ante otros machos, agresividad, territorialismo y mejores cornamentas.