3.3 ESPERMATOGÉNESIS
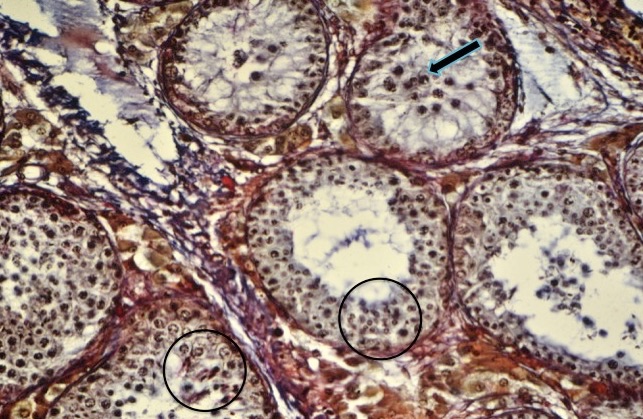
Al nacimiento, las células germinativas en los machos son llamados gonocitos. Los túbulos seminíferos son pequeños y no tienen lumen, la población celular está compuesta apenas por los gonocitos y células de soporte que darán origen a las células de Sertoli (figura 3).

Los túbulos se encuentran rodeados por gran cantidad de tejido intersticial que contiene principalmente células mesenquimales precursoras de las células de Leydig. Cuando la diferenciación celular empieza a manifestarse, ocurre la formación del lumen del túbulo seminífero (figura 4).
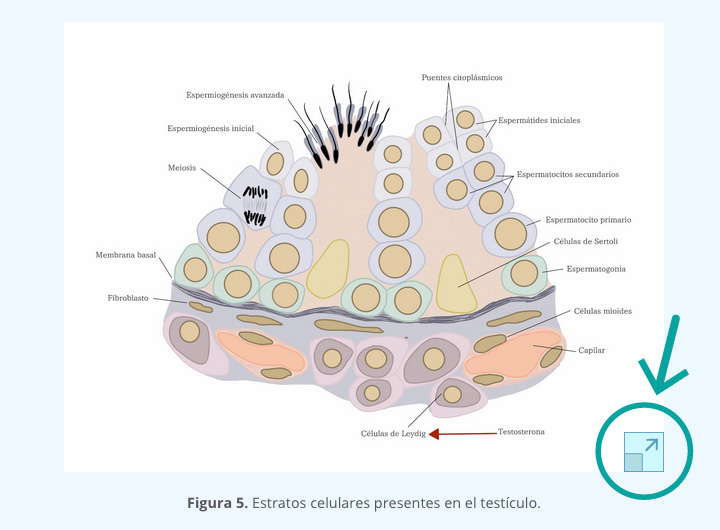
Antes de la pubertad, la diferenciación celular se manifiesta primero por la presencia de espermatocitos primarios, los cuales en general se degeneran en la fase de paquiteno, por falta de estímulo hormonal. Al acercarse la pubertad, las espermatogonias empiezan a dividirse aceleradamente por mitosis, mientras que en el espacio intersticial las células mesenquimales también empiezan a diferenciarse y a dar origen a las células de Leydig (figura 5).

La población de células de Sertoli es definida durante la última fase de la gestación y después del nacimiento, siendo principalmente controlada por la producción de FSH. Este patrón de multiplicación produce una población fija en tamaño después de la pubertad y cuantitativamente estable durante toda la vida del animal, existiendo aún una relación directa entre el tamaño de la población total de células de Sertoli con la producción de un adecuado número de espermatozoides en la vida adulta.
Éstas células son las únicas células somáticas que están en el epitelio seminífero (interactivo 5) y su función es la nutrición, sustentación y control endócrino de las células germinales, también participan activamente en el proceso de liberación de los espermatozoides a la luz del túbulo. En este momento las células de Sertoli realizan la fagocitosis de parte de los cuerpos residuales, es decir, parte del citoplasma del espermatozoides, también fagocitan las células germinales que se degeneran en el curso normal de la espermatogénesis. Asimismo, sintetizan innumerable cantidad de proteínas como por ejemplo las proteínas ABP (androgen binding protein-proteína de unión al andrógeno) que transportan andrógenos para todo el aparato reproductivo, transferrinas que transportan hierro para la respiración de las células germinativas y también las inhibinas que regulan la liberación de FSH por la hipófisis, a través de un sistema de retroalimentación negativa (video 4).
Las células peritubulares o mioides están situadas alrededor del túbulo seminífero y se piensa que éstas promueven la contracción y la integridad estructural del túbulo. Este tipo celular apenas se diferencia en la pubertad por la acción de los andrógenos.
Las interacciones entre las células de Sertoli y las células mioides parecen tener un papel importante en el mantenimiento de las funciones del testículo.
Las espermatogonias A0 son la fuente para la continua producción de gametos. La mitad de ellas se dividen y forman células iguales (las llamadas células tronco); aproximadamente la otra mitad forma espermatogonias A1 que nuevamente por divisiones mitóticas forman espermatogonias A2, A3 y A4. El tipo A4 sufre mitosis para formar la espermatogonia intermedia (A In), que a su vez por mitosis forma la espermatogonia B.
Estos tipos de espermatogonias, pueden ser identificados en evaluaciones histológicas de acuerdo a su organización topográfica en la membrana basal de los túbulos seminíferos o su contenido de heterocromatina. Otra manera de diferenciación es basada en marcadores moleculares específicos que distinguen las espermatogonias tronco (A0) de las demás espermatogonias, con los fines de aislamiento y desarrollo in vitro. Las espermatogonias B pasan por mitosis para formar los espermatocitos primarios; éstos inician la primera etapa de la meiosis para dar lugar a los espermatocitos secundarios. En la segunda etapa de la división meiótica cada espermatocito secundario se divide para formar las espermátidas (figura 6).
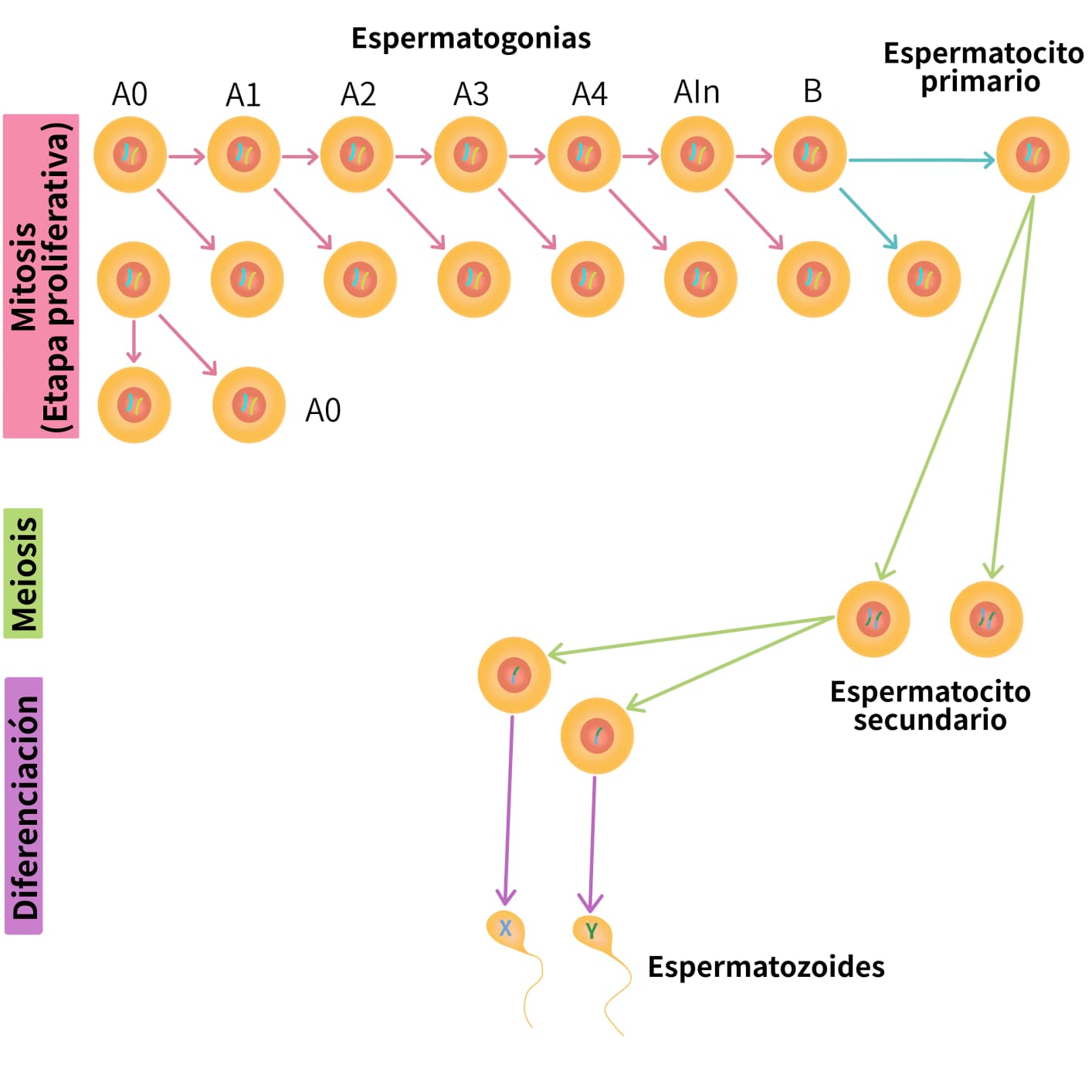
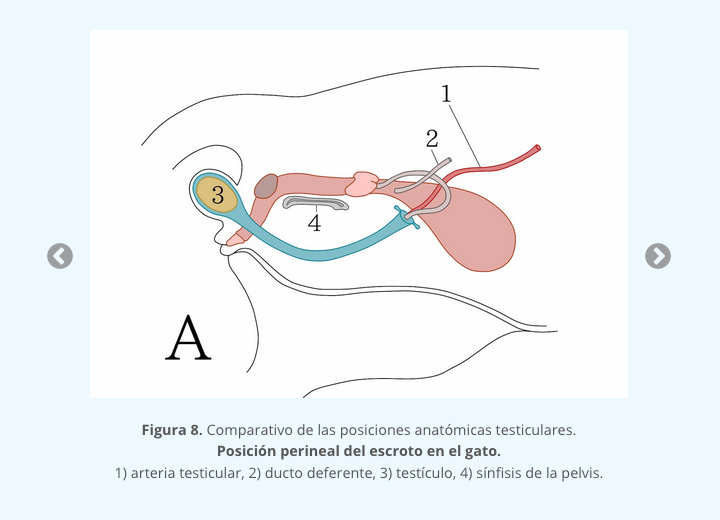
Cuando el testículo alcanza su desarrollo total, la meiosis se completa y las espermátidas originadas se convierten en espermatozoides. Uno de los signos característicos de este fenómeno es el alargamiento de las espermátidas y su migración hacia el lumen del túbulo (figuras 7 y 8).


Fases de la espermatogénesis:
- Fase proliferativa: después de la pubertad y durante la vida reproductiva del macho, las espermatogonias se dividen de una manera rápida y sucesiva por mitosis: tipo A0 (células tronco), las A1-A4, las intermedias, y las de tipo B. Todas ellas representan estadios sucesivos del desarrollo de la espermatogonia (figura 9).
- Fase meiótica: el material genético se recombina. El espermatocito primario realiza su primera división meiótica o reduccional para dar origen a los espermatocitos secundarios. Esta es una fase prolongada donde ocurren los cambios de material genético entre los pares de cromosomas. Las fases de ésta división son iguales a las que ocurren en la meiosis de la hembra. Durante este período no sólo se realiza la reducción en el número de cromosomas somáticos, sino que también los cromosomas sexuales se separan de manera que un espermatocito secundario recibe el cromosoma X y el otro el cromosoma Y. en la segunda división meiótica de cada espermatocito secundario se producen dos espermátidas.
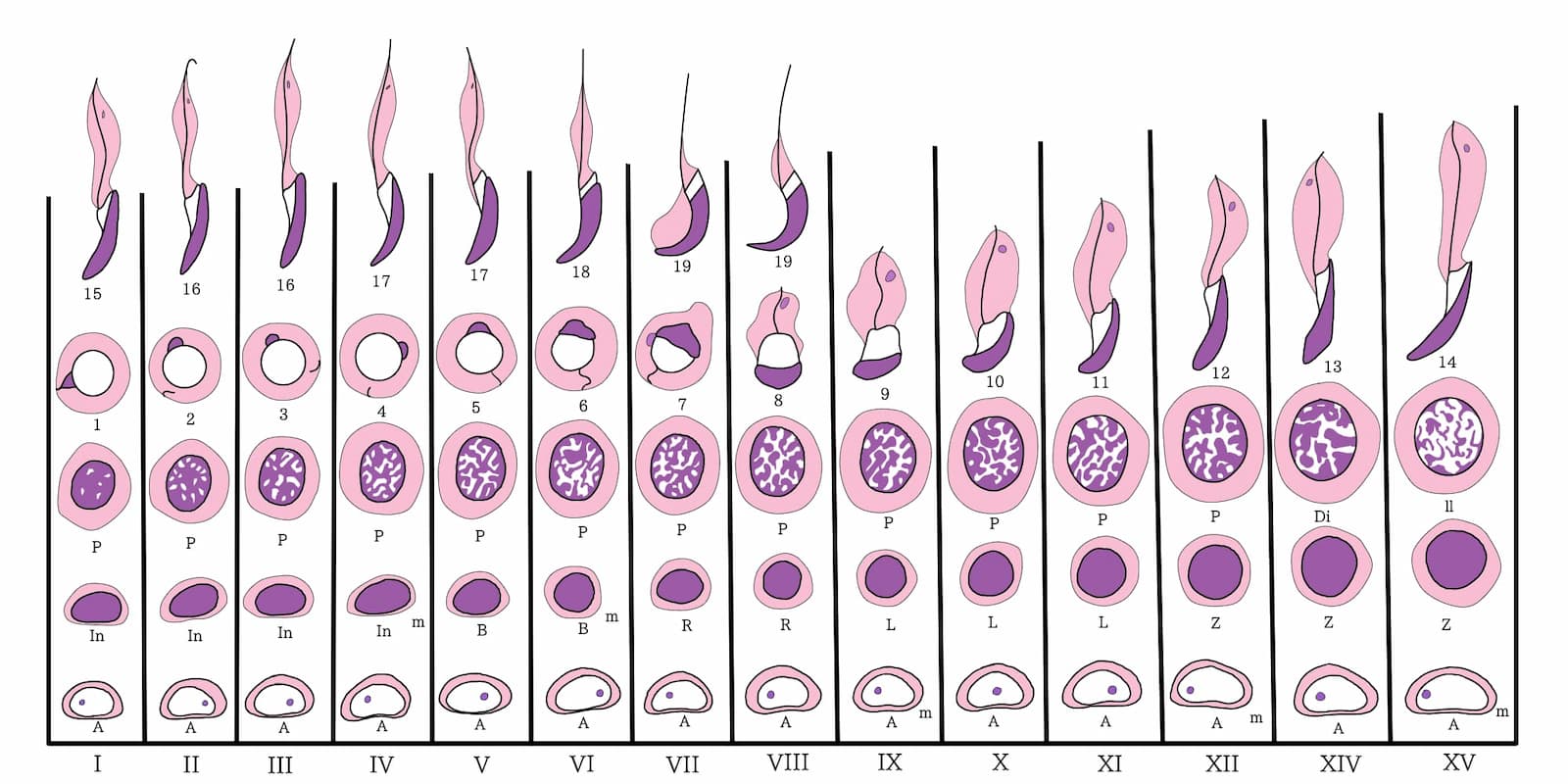
- Fase de diferenciación o fase espermiogénica: consiste en la transformación de las espermátidas en espermatozoides estructuralmente equipados para fertilizar al óvulo. Estos son cambios que ocurren cuando las espermátidas están en contacto con el citoplasma de la célula de Sertoli. Durante este proceso comienzan a diferenciarse las partes que constituyen el espermatozoide, primero la cabeza formada casi exclusivamente por el núcleo, el acrosoma o capuchón cefálico, el cuello y la cola, que es la porción motora del espermatozoide (figuras 10 y 11). El ciclo espermatogénico de la rata ha sido clasificado en 14 estadios, basados en la morfología de las espermátidas. Sin embargo, para otras especies hay clasificaciones menos elaboradas, como en el caso de los humanos, en los que solamente se consideran seis estadios, y los toros, con ocho. Las diferencias en las clasificaciones entre especies dependen de qué característica del ciclo se considera en el estadio I, si es la fase posmeiótica, donde están las espermátidas recién formadas de la meiosis II (como en las ratas, humanos y canes), o la fase de posliberación de los espermatozoides en el lumen (como en el caso de los toros).


La testosterona, hormona esteroide producida por las células de Leydig, es esencial para el mantenimiento y restauración de la espermatogénesis así como para desarrollar y mantener las características secundarias masculinas. La acción de la FSH está más enfocada en las fases gestacional, prepuberal y puberal, donde se desarrolla la espermatogénesis. Por ejemplo, en el animal adulto, los niveles basales de FSH son suficientes para mantener la función espermatogénica normal.
Sin embargo, la FSH interactúa con los receptores de las células de Sertoli estimulando la producción de ABP e inhibina, y también la división de las células germinales. La inhibina actúa bloqueando la liberación de FSH y estimulando la liberación de LH. La hormona LH en el testículo tiene la función de estimular la secreción de andrógenos por las células de Leydig, y por consiguiente, estimula la proliferación del epitelio seminífero, ya que existen receptores para estos esteroides en las células germinales. Los andrógenos son transportados desde el espacio intersticial hacia el epitelio seminífero y hacia todo el aparato reproductor por proteínas transportadoras o ligadoras de andrógenos (ABP) producidas por las células de Sertoli (video 5).
Está bien establecido que el control de la espermatogénesis depende de la función del eje hipotálamo-hipófisis-testicular. Sin embargo, muchos estudios indican la importancia de la regulación de la espermatogénesis a nivel paracrino-autocrino, o sea, a nivel local.
Aunque la FSH aumenta la viabilidad del epitelio seminífero así como la proliferación de las espermatogonias y que los andrógenos sean esenciales para la diferenciación del aparato reproductivo masculino, no son suficientes para inducir el desarrollo normal de la espermatogénesis. El desarrollo de la función testicular requiere también una producción de factores locales y una interacción de célula a célula que regula el crecimiento y la diferenciación del tejido.
Los factores locales envueltos en las interacciones entre células de Sertoli, de Leydig y germinativas incluyen factor de crecimiento de insulina 1 (IGF-1), inhibina, factor de crecimiento transformante β (TGF-β), oxitocina, vasopresina (ADH), opioides, esteroides, citocinas (Interleucinas 1 y 6, así como el factor inhibidor de migración de macrófagos-MIF). Estas citocinas son producidas por las células de Sertoli, células germinativas, macrófagos y células de Leydig, las cuales actúan en la modulación de la espermatogénesis. En algunas especies, incluyendo el hombre, los macrófagos representan el segundo tipo celular intersticial más numeroso en el testículo después de las células de Leydig. Macrófagos y varios subtipos de linfocitos son identificados en los testículos de carneros y ratones. Los macrófagos están en íntima asociación con las células de Leydig y actúan juntos en la regulación de la esteroidogénesis.